脑刺激不再“一刀切”:斯坦福大学提出“千人千脑”精准干预新框架
随着全球老龄化加剧,阿尔茨海默病、帕金森病、卒中后认知障碍及老年抑郁症等与衰老相关的神经精神疾病(ANMDs)日益高发。非侵入性脑刺激(NIBS)作为一类有前景的非药物干预手段,虽展现出潜力,但其临床效果却因人而异。为何同样的刺激方案在不同老人身上效果天差地别?最新综述提出:关键在于从“标准化”走向“以人为本”,本文系统解读这一突破性框架。
1 引言
无创脑刺激(NIBS)作为数字非药物干预(dNPIs)的重要工具,在阿尔茨海默病、帕金森病、卒中及老年抑郁症等与衰老相关的神经精神疾病(ANMDs)中展现出潜力。经颅直流/交流电刺激(tDCS/tACS)、重复经颅磁刺激(rTMS)和经颅超声刺激(TUS)可通过调节功能失调的神经回路,改善认知、运动与情绪功能,但其疗效在老年人群中高度不一致。
这种异质性源于两大挑战:一是个体间差异(如脑萎缩、白质病变、网络重组),二是个体内波动(如状态依赖的神经可塑性、跨会话反应变化)。然而,当前多数方案仍采用“一刀切”策略,靶点、参数、疗程及联合干预缺乏个性化定制。例如,老年抑郁症患者中TMS有效率仅约50%,且与额叶体积显著相关;痴呆患者因皮层萎缩导致高清tDCS电流分布变异,部分人需超常规剂量才能达到有效刺激强度。
尽管已有研究尝试引入个性化元素——如基于结构/功能MRI的靶点定位、闭环神经反馈调控、或与认知/运动训练联用。但这些策略多孤立应用,未能系统整合个体间与个体内变异性。静态影像导航忽略实时状态变化,闭环系统常依赖单一生理信号,而联合干预少有参数协同优化。
为此,研究人员提出一个以人为本的多维NIBS设计框架,系统整合四个关键维度:
l 大脑结构与功能的个体间差异(通过sMRI/fMRI精准靶向);
l 干预背景的个体间差异(如共病、用药、认知储备);
l 实时神经行为状态的个体内波动(通过多模态闭环动态调整);
l 跨会话神经可塑性的累积变化(通过剂量-反应建模优化疗程)。
该框架以提升神经资源的可获得性与参与度为核心目标,前者指可用于调动的结构性与功能性储备,后者指干预中神经系统的实时响应与长期适应能力。研究人员并非推荐特定刺激模式或靶区,而是强调整合共通的个性化组件,从而增强靶向精度,并强化刺激与临床获益之间的因果链。

2 当前NIBS个性化方案在老年疾病中的应用现状
关于以人为本的NIBS在衰老相关神经精神疾病(ANMDs)中的应用,研究人员系统回顾了现有随机对照试验(RCT),重点关注个性化策略对靶点参与度和临床结局的影响。综述涵盖老年抑郁症、帕金森病(PD)、阿尔茨海默病(AD)和卒中四大疾病,共纳入38项研究,其中以重复经颅磁刺激(rTMS,22项)和经颅直流电刺激(tDCS,13项)为主,经颅交流电刺激(tACS)和经颅超声刺激(TUS)研究较少(各2项和1项)。当前个性化策略主要包括两类:一是利用结构或功能神经影像(如sMRI、fMRI、EEG、fNIRS)在干预前精确定位刺激靶点;二是将NIBS与认知训练、物理康复或药物治疗等补充干预结合。仅有3项研究实现了闭环NIBS,即基于实时神经行为信号(如皮层振荡、步态节律或震颤活动)动态调整刺激参数。
在靶点定位方面,大多数研究采用sMRI引导解剖靶向(如左侧背外侧前额叶皮层DLPFC用于AD和老年抑郁,对侧运动皮层用于卒中),而新兴工作则利用fMRI识别个体化功能网络。少数研究探索了EEG衍生的皮层振荡。总体而言,影像引导的NIBS在改善认知或运动功能方面常优于假刺激组,但也有例外。一项卒中研究发现,sMRI引导的rTMS联合上肢训练并未显著优于非运动区假刺激,可能因安慰剂方案本身具有潜在神经调控效应。
在联合干预方面,rTMS、tACS和TUS与认知或物理训练结合时,多显示出增强的靶点参与和临床获益;而tDCS联合训练的效果则不一致——11项相关研究中仅5项报告主动刺激显著优于假刺激。这种差异可能源于tDCS较低的空间分辨率,以及训练任务参数(如难度、时长)与刺激方案缺乏协同优化。
至于闭环NIBS,尽管在理论上能动态适应个体内状态波动,但目前仅3项RCT验证其在ANMDs中的应用:包括基于步态节律调整tACS相位(PD)、根据感觉运动μ振荡触发rTMS(卒中),以及锁相刺激抑制震颤。然而,其临床优势尚未明确——例如,一项卒中研究显示,靶向患侧M1的闭环rTMS虽有效,但未优于标准对侧运动皮层低频rTMS方案,可能与靶点选择差异有关。

图1 多模态整合装备
3 构建以人为本的NIBS多维设计框架
3.1 以人为本的NIBS如何改善老年神经精神疾病临床结局?——概念框架解析
基于已识别的挑战与潜在解决方案,研究人员提出一个以人为本的NIBS方案概念框架,系统解决ANMDs中的个体间差异和个体内差异,以增强神经资源的可利用性和参与度,从而最大化临床效果(图2A)。接下来会详细介绍4个关键维度:
ü 个体间解剖与功能差异
衰老相关的神经退行性变或疾病特异性病理影响NIBS期间的神经资源利用。例如,AD相关痴呆(ADRD)和轻度认知障碍(MCI)中,脑萎缩降低tDCS的E-field分布效率;晚年抑郁症中,rTMS的效果因皮质兴奋性和可塑性改变而减弱。这些因素需要个性化调整,如优化tES强度或电极配置,以实现有效神经调节。
ü 干预背景中的个体间差异
NIBS与其他干预措施的结合方式也影响神经资源利用。例如,PD患者中,tDCS与多巴胺增强药物联合使用可增强运动学习能力;NIBS与认知或运动训练结合能产生协同效应。然而,许多研究孤立应用NIBS,错失了优化机会。
ü 实时神经行为动态的个体内差异
刺激期间的内源性神经振荡状态影响神经资源参与。例如,theta-tACS在个体峰值频率下可最大化静息态振荡功率调节,而略低于峰值频率的theta-tACS则提高记忆容量表现。针对特定神经振荡状态定制刺激(如顶下小叶IPL theta-tACS用于工作记忆,DLPFC gamma-tACS用于长期记忆)可增强效果,错位可能导致无效甚至不良反应。
ü 跨会话累积神经可塑性效应的个体内变化
短期反应和长期疗效受跨会话累积神经可塑性效应影响。优化剂量——包括刺激配置、疗程长度、频率和总疗程次数——至关重要。例如,加速方案通过每天多次疗程加快治疗进程,但需监测效果-耐受性平衡,以减少副作用。
真正以人为中心的NIBS不应仅关注“打哪里”,而应系统整合大脑基线特征、干预生态、实时状态与纵向可塑性这四个维度,形成一个动态、闭环、协同的个性化干预体系。
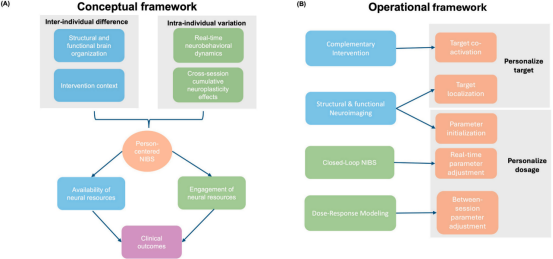
图2 衰老相关神经精神疾病(ANMDs)中以人为本的非侵入性脑刺激(NIBS)用于干预方案设计的概念框架(A)与操作框架(B)
3.2 以人为本NIBS个性化策略的实操要点
在概念框架的基础上,操作框架提出在以人为本的NIBS中,个性化刺激靶点和剂量。这种方法整合了个体差异的四个维度,目标是为以人为本的NIBS方案设计提供精确的刺激靶点和剂量(见图2B)。
3.3 结构与功能神经影像:精准定位个体化靶点
3.3.1 目标定位
结构与功能神经影像(sMRI/fMRI/EEG/fNIRS)可揭示个体脑组织差异,指导NIBS靶点定位并评估神经资源可利用性。当前ANMDs研究多依赖sMRI或fMRI引导的皮层或网络靶向,而新兴工作聚焦sMRI引导的经颅超声刺激(TUS),利用其高空间精度靶向深部结构(如基底神经节)。初步研究表明,加速theta爆发TUS可增强帕金森病M1兴奋性并改善阿尔茨海默病认知,但其效果受多巴胺状态和病理改变(如胶质瘢痕、白质病变)影响——这些变化会干扰声波传播、降低靶点稳定性。
3.3.2 参数初始化
将结构/功能神经影像与基于有限元方法(FEM)的电场(E-field)建模结合,可依据个体解剖特征(如脑萎缩、白质病变)模拟NIBS在脑内的电流分布,从而优化TMS(线圈位置、方向、强度)和tES(电极排布、电流剂量)的个性化靶向与参数设置。研究显示,在老年人tDCS中纳入年龄相关解剖变化可显著提升电流密度估算的准确性,忽略萎缩和白质病变会高估实际刺激强度。进一步整合fMRI功能连接(FC)可实现网络层面的精准靶向,减少脱靶效应,并有助于识别抑郁症中对特定TMS靶点更可能响应的患者。
3.4 闭环NIBS
闭环非侵入性脑刺激(NIBS)通过实时感知神经生理动态并自适应调整刺激参数,有望显著提升干预过程中神经资源的参与度。一个完整的闭环系统包含传感器、控制器和刺激器,分别负责采集信号、识别状态模式并输出调控指令。然而,当前针对衰老相关神经精神疾病(ANMDs)的闭环NIBS研究大多依赖单一外周模态(如肌电图、加速度计或压力传感器),主要关注运动输出,而忽视了对中枢神经系统(如EEG皮层振荡)与外周自主神经活动(如心率变异性)的同步监测。这种单模态策略难以全面刻画ANMDs中多尺度、多系统的神经行为动态,限制了对目标神经资源的有效调动。相比之下,其他神经调控技术——如闭环深部脑刺激(DBS),已成功整合脑皮层电图、局部场电位与行为指标,通过状态空间模型实现更精准的认知或运动调控。
要推动闭环NIBS向临床实用迈进,需在感知与控制两端协同突破。一方面,应构建融合中枢与外周信号的多模态监测框架,全面反映个体在刺激中的实时功能状态;另一方面,需升级控制算法,从简单的阈值触发或锁相刺激,转向基于模型预测控制(MPC)、贝叶斯优化(BO)或强化学习(RL)的智能策略,以动态追踪目标神经状态并优化长期可塑性。未来,整合多模态感知与自适应学习的闭环NIBS系统,有望实现会话内精准调控与跨会话持续优化,真正迈向状态依赖、个体化的智能神经干预。
图3 Visor2TM神经导航
3.5 剂量-反应建模
除实时闭环调控外,剂量-反应建模可通过分析跨会话神经可塑性累积效应,优化纵向NIBS的参数安排(如疗程频率、总次数),以提升神经资源的持续参与。个体在可塑性潜力(如认知储备)上的差异要求个性化剂量策略——例如加速iTBS虽起效快,但需权衡习惯化或头痛风险。尽管机器学习已用于优化tDCS电极配置和预测应答者,目前仍缺乏对个体内神经行为反应变异性的建模,难以构建ANMDs特异的剂量-反应曲线。尤其在AD中高频刺激可能诱发海马过度兴奋,PD中长期iTBS或导致适应不良可塑性,而这些问题源于纵向干预中会内/会间神经行为数据的缺失。未来需结合多模态监测与剂量-反应模型,实现更安全、精准的个性化调控。
4 讨论
4.1 以人为本的NIBS实施注意事项
尽管研究人员提出了一个以人为本的多维NIBS框架,但在单一临床或研究项目中全面实施所有策略仍面临现实挑战,包括技术门槛、成本限制以及参与者负担。因此,个性化策略的选择应基于两个关键因素:目标神经回路与临床结局的复杂性,以及干预手段的可及性与资源需求。对于回路明确、机制相对简单的干预目标(如卒中后初级运动皮层M1的兴奋性调节),可采用低成本且易操作的方法,例如基于标准运动诱发电位(MEP)定位的TMS联合常规物理治疗。对于中等复杂性目标,剂量-反应建模可在适度资源条件下实现会话间的参数优化。而对于高度复杂的动态网络,则可能需要整合结构/功能影像引导与实时闭环调控,但这类策略目前仅适用于具备高级设备与专业团队的中心。
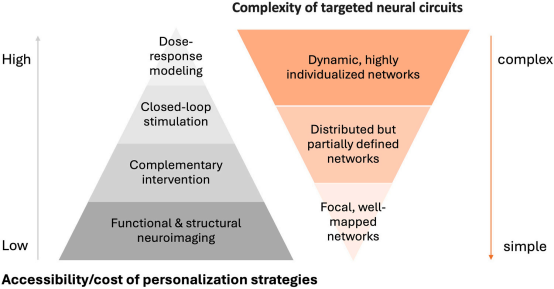
图4 实施以人为本的非侵入性脑刺激(NIBS)的实践考量
展望临床转化,随着算法自动化、硬件小型化和信号处理流程的成熟,闭环NIBS和剂量-反应模型有望逐步进入常规实践;而基于神经影像的靶向仍将是最资源密集的环节。在具体疾病应用中,可针对性优先核心组件:针对认知障碍(如AD),应优先利用sMRI/fMRI校正皮质萎缩并靶向默认模式网络,同步结合认知训练与纵向剂量调整以应对神经退行性进展;针对运动障碍(如帕金森病或卒中),宜聚焦闭环NIBS,在运动执行中实时同步刺激与神经行为状态,并精细协调物理训练时机与药物周期;针对晚年抑郁症,则需通过影像个体化定位受萎缩影响的前额叶-边缘回路,并联合抗抑郁药物与剂量-反应建模,以适应老年人群皮质兴奋性变化和治疗可持续性需求。这一分层、务实的实施路径有助于在现有条件下最大化NIBS的临床价值。
4.2 以人为本的NIBS的挑战与机遇
以人为中心的NIBS中各类个性化策略的可行性与稳定性均受ANMDs疾病特异性及共性神经退行性变的制约。阿尔茨海默病中的皮质萎缩、白质病变和神经血管解耦可削弱fMRI靶向的可靠性;帕金森病的深部靶点变异、运动伪影(如震颤)及多巴胺能药物“开/关”状态显著干扰影像引导和闭环反馈,并影响剂量-反应建模;卒中后胶质瘢痕改变组织电导率与声阻抗,扭曲电场或超声焦点,而高度异质的运动障碍也限制行为触发闭环的稳定性;晚年抑郁症则表现为fMRI连接模式波动大、神经反馈生物标志物不稳定。此外,跨疾病的共同挑战包括衰老相关的脑结构退化、高合并症负担、重复MRI成本高且可及性低,以及老年患者对复杂干预耐受性有限。有效应对这些病理-技术交互作用,是将多维个性化框架转化为疾病定制化NIBS方案的关键。
脑不是千篇一律的机器,尤其在衰老与疾病面前,每个人的大脑都在以独特的方式变化。标准化的“一刀切”脑刺激,或许已经走到了它的天花板。斯坦福团队提出的这个多维、动态、真正“以人为本”的NIBS框架,不只是技术的升级,更是一种理念的转变。从“我们怎么刺激大脑”,转向“你的大脑此刻需要怎样的支持”。未来,当神经影像、闭环调控、剂量建模和行为干预真正协同起来,非侵入性脑刺激才可能从实验室走向千千万万老人的真实生活,成为精准、可及、有温度的神经康复工具。而这一切,始于对个体差异的尊重。
文章信息
引用:Zhou, S., Keller, C. J., Chen, N. F., Adeli, E., & Lin, F. V. (2025). Person-Centered Noninvasive Brain Stimulation for Aging-Related Neurological and Mental Disorders: A Multi-Dimensional Framework for Designing Protocols. Neuroscience & Biobehavioral Reviews, 106528.
DOI: 10.1016/j.neubiorev.2025.106528




